Instituto
Tecnológico de Estudios Superiores de Monterrey
Campus
Puebla
Escuela
de Ingeniería y Ciencias Aplicadas
Departamento
de Biotecnología
Laboratorio de
Química Experimental-Q.1014.01
Dr. Isaac Monroy
Mtro. Víctor H. Blanco
Práctica 9: Conservación de la
materia, reactivo limitante, rendimiento teórico y rendimiento real.
Equipo 7:
Laura Barba Castillo A01322562
Alejandro
Larios Campos A00399515
Rodrigo E. Hernández Jiménez A01324406
Brenda Berenice Jerónimo Atanacio A01324138
Fecha
de entrega: jueves 21 de febrero de 2013
Objetivo:
·
Escribir una ecuación química ajustada para
descubrir una reacción química.
·
Usar el concepto de reactivo limitante en
cálculos con ecuaciones químicas.
· Comparar la cantidad de sustancia realmente
formada (rendimiento real) con la cantidad predicha (rendimiento teórico) y
determinar el porcentaje de rendimiento.
Introducción
La ley de la conservación de la materia enunciada por Antoine
Lavoisier enuncia que la masa de una material permanece constante a pesar de
cambiar de estado o de compuesto. En otras palabras, la masa del universo es
constate, y en una reacción química, los átomos de los reactivos son iguales
que en los productos, únicamente ordenados de manera distinta. (Otamendi, 2001)
En una reacción química
existen:
• Reactivo
limitante. Aquel reactivo que se consume por completo en la reacción, una vez
que este se termine entonces la reacción se detendrá.
• Reactivo en
exceso. Es el reactivo que se encuentra en mayor proporción de la necesaria, es
conveniente que exista un reactivo en exceso ya que así se favorecerá la
reacción.
• Rendimiento
teórico. El rendimiento teórico de una reacción es el rendimiento que se
calcula suponiendo que la reacción es completa.
• Rendimiento real.
Es la cantidad de producto puro que realmente se obtiene en una reacción en
particular.
• Rendimiento
porcentual. Se utiliza para indicar la cantidad que se obtiene de un producto
deseado en una reacción. Es la relación del rendimiento real entre el
rendimiento teórico multiplicado por 100.
• Porcentaje de
pureza. El porcentaje de pureza es el porcentaje de masa de una sustancia específica
de una muestra impura. Normalmente las sustancias en el laboratorio tienen un
grado de pureza. (Whittten. 2008)
Al pesar sustancias es fácilmente cometer errores de medición,
debido a diversas causas, ambientales, humanos y de instrumentos. Muchas veces
la recuperación total de los productos
es imposible o existen sustancias difíciles de obtener es por ello que el
rendimiento porcentual se ve disminuido. Es sumamente trabajar en instrumentos
confiables, calibrados que nos den medidas exactas pero de igual manera el
laboratorista debe tener especial atención para recuperar la mayor cantidad de
productos. (Wilches, 2007)
Desarrollo
Experimento 1. Globo
1. Se midieron
10ml de agua destilada y 6.2ml de ácido clorhídrico, los cuales se colocaron en
un matraz Erlenmeyer.
2. Se cortó en
trozos media tableta de Alka-Seltzer y se colocó en un vidrio de reloj, se pesó
y se introdujo en el globo.
Figura 1. Pesado del Alka-Seltzer.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
3. Se embonó el
globo en la boca del matraz cuidando que no cayera el Alka-Seltzer dentro. Se
pesó el sistema.
Figura 2. Pesado del sistema inicial.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
4. Se dejó caer
el Alka-Seltzer dentro del matraz y se agitó. Se pesó el sistema y se midió el
diámetro del globo inflado.
Figura 3. Pesado del sistema con el gas.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Figura 4. Medición del diámetro del globo.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
5. Se picó el
globo con una aguja para dejar escapar el gas. Se pesó de nuevo el sistema y se
midió la temperatura del líquido en el matraz.
Figura 5. Pesado del sistema sin gas.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Experimento 2.
1. Fueron
pesados 0.1021 g de Zn metálico en la balanza analítica, después se agregaron
al matraz Kitazato. Éste fue tapado, bien ajustado, con un tapón de caucho sin
horadar.
2. Se preparó
una solución de 50 ml de HCl 1 M. Mediante los siguientes cálculos:
3. Se armó el
siguiente equipo para realizar el experimento. Llenando la probeta al máximo de
su capacidad. La manguera, la cual es el medio de salida del gas, no debía
contener mucho aire pues afectaría el volumen.
Figura 6. Equipo armado para llevar a cabo
el experimento.
Fuente. Laboratorio de Química Experimental,
ITESM, Campus Puebla.
4. Con una
jeringa se midieron 5 ml de la solución de HCl 1 M, sucesivamente la aguja de
la jeringa se introdujo al matraz a través del tapón para agregar los 5 ml de
HCl y se llevara a cabo la reacción.
5. Se observó
lo ocurrido y se tomó en cuenta el volumen que se logró recolectar en la
probeta para hacer los cálculos necesarios y obtener los resultados.
6. Se
desensamblo el equipo para el experimento.
7. Los desechos
fueron colocados en el lugar indicado.
8. Los
instrumentos de laboratorio ocupados fueron lavados adecuadamente.
Experimento 3.
Tabla 1.
1)
Cobre metálico + ácido nítrico →
|
Nitrato
de cúprico
|
2)
Nitrato de cúprico+ Hidróxido de sodio →
|
Hidróxido
Cúprico
|
3)
Hidróxido de cúprico + calor→
|
Oxido
cúprico y vapor de agua
|
4)
Oxido cúprico + ácido sulfúrico →
|
Sulfato
cúprico
|
5)
Sulfato cúprico + Zinc metálico →
|
Cobre
metálico
|
1. El alambre
de cobre fue colocado en un vaso de precipitado de 250 ml y fue llevado a la
campana puesto que al agregar HNO3 se produjo una reacción tal que
produjo gases tóxicos color café. La reacción provoco que el alambre de cobre
se deshiciera. Presentó un color verde/azul. Después se agregó agua destilada
al vaso con la reacción lo cual hizo que se formara un color azul turquesa. Mientras
tanto, en una parrilla eléctrica se pusieron a calentar 200 mil de agua
destilada en un vaso de precipitado de 250 ml.
Cu + 4NO3
à Cu(NO3)3
+ 2NO2 + 2H2O
Figura 7. Reacción
para obtener nitrato cúprico.
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
Figura 8. Producto de
la primera reacción después de agregar agua destilada.
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
2. Posteriormente
se añadieron 15 ml de una solución de
NaOH 3M a la sustancia que resulto de la reacción anterior para la
obtención de Cu(OH)2 la cual presento un cambio de color comparable
a la reacción anterior además se presentaron pequeños fragmentos inversos en la
solución.
Cu(NO3)2 + 2NaOH à 2NaNO3
+ Cu(OH)2
Figura 9. Solucion de Hidroxido
de Sodio 3 Molar
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
Figura 10. Producto de la
reaccion para obtener Hidroxido cúprico.
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
3. El producto
de la reacción anterior fue puesto en la parrilla eléctrica para ser calentado,
se tomó en cuenta que debe ser agitado con la varilla de vidrio. La sustancia
comenzó a ebullir. Antes de ebullir la sustancia comenzó a presentar un color
café oscuro presentando grumos que se separaban de la parte acuosa, lo cual
permitió que después éstos se pudieran separar mediante un decantado. A la
parte sólida que quedó en el vaso de precipitado se le agregaron 100 ml de agua
destilada que se había puesto a calentar desde el inicio lo provocando que el
sólido se quedara abajo y facilitara el decantado. Todo esto con el fin de
obtener CuO ¿Qué se está eliminando con
el lavado y la decantación? Se están eliminando las impurezas el CuO.
Cu(OH)2
+ calor à CuO + H2O
Figura 11. Lavado y
decantación para la obtención de Oxido Cúprico
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
4. Al sólido lavado anteriormente se le añadió H2SO4
y al ser agitado presento una disolución en la cual no se distinguían los
componentes. En la solución se presentan iones de oxígeno, cobre, sulfato e
hidrogeno. El producto de interés que se obtuvo en esta reacción fue Sulfato de
Cobre. Presentó un color azul claro, además la reacción provoco calor.
CuO + H2SO4 à CuSO4 + H2O
Figura 12. Obtención de ácido sulfúrico
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
5. En este paso del experimento se añadieron
pequeñas porciones de Zinc lo que provoco que se propiciara un gas y una parte
se pusiera incolora.
CuSO4 + Zn à ZnSO3 + Cu
6. Para llevar a cabo el tratamiento del
precipitado se agregó acetona para eliminar las impurezas de la solución. El
color rojizo que se presentó anteriormente no cambio.
Figura 13. Cobre metálico
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
Experimento 4. Hidróxido de cobre
1. Se midieron
20ml de sulfato de cobre y 40ml de hidróxido sódico, ambas 0.5M.
Figura 14. Soluciones medidas, a la derecha el hidróxido de sodio y a la izquierda sulfato de cobre.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
2. Se montó un
equipo de filtrado.
3. Se pesó un
papel filtro y se colocó en el embudo.
4. Se vertió el
sulfato de cobre en el hidróxido sódico.
Figura 15. Sulfato de cobre con el hidróxido sódico.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
5. Se vertió el
contenido en el embudo y se lavó hasta que todo el precipitado quedara en el
filtro.
6. Una vez que
se filtró la mayor cantidad, se tomó el
papel filtro y se colocó en un vidrio de reloj.
Figura 16. Papel filtro con el hidróxido de cobre ya filtrado.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
7. Se dejó
secar a temperatura ambiente.
8. Una vez seco
se pesó.
Resultados
Experimento 1. Globo
La
reacción química observada fue una reacción de doble sustitución representada
mediante la siguiente ecuación:
NaHCO3 + HCl à CO2 +NaCl+H2O
Antes
de iniciar la reacción, se midió una masa de 39.0449g para el sistema. Una vez
finalizó la reacción, se midió una masa de 38.9367. Finalmente, al liberar el
gas del sistema, se calculó por diferencia de masas una masa de 0.2271g de CO2.
Se realizó una corrección al error por flotación mediante la siguiente
ecuación:
W1=W2+W2(ρ aire/ ρ gas- g aire/ ρ pesa)
W1=0.2271+0.2272(0.60581)=0.36484
g CO2.
Donde:
Densidad
del aire= 1.2x10-3 g/cm3
Densidad
de CO2= 1.98x10-3 g/ cm3
Densidad
de pesa= 8 g/ cm3
Tabla 2. Conservación de la materia en la reacción.
Masa Inicial (g)
|
39.0449
|
Porcentaje de error
%
|
Masa experimental (g)
|
38.9367
|
0.27
|
Masa Corregida (g)
|
39.07434
|
0.07
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Al
sumar este valor con el volumen del sistema al finalizar la reacción se calculó
la masa de 39.07434g. Mediante el diámetro del globo en el sistema
posterior a la reacción, se determino el volumen de gas en el mismo mediante la
siguiente ecuación:
Volumen=4/3 pi r3=130.92430
cm3
Mediante
este valor se obtuvo la masa teórica utilizando la densidad reportada en al
literatura, la cual dio como resultado 0.2592g de CO2. A partir del cálculo de volumen se cálculo
una tercera masa considerando al gas producido como un gas ideal en condiciones
normales, mediante la siguiente ecuación:
PV=nRT
n=PV/RT
n=(1)(0.13092430)/(0.082)(301)=5.30x10-3
x 44.01 g/mol= 0.2334g
Los
resultados finales de masa para el CO2 producido se resumen en la
siguiente tabla:
Tabla 3. Determinación de masa de CO2
producido.
Valor Teórico (g)
|
Método de
determinación
|
Masa (g)
|
Porcentaje de error
(%)
|
0.2592
|
Diferencia de masas
|
0.2271
|
12.38
|
Diferencia de masas
corregida
|
0.3648
|
40.7
|
|
Ecuación de los
gases ideales.
|
0.2334
|
9.95
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Mediante
los valores de masa en la tabla y el volumen calculado se determinaron las
siguientes densidades experimentales y pesos moleculares:
Tabla 4. Densidades y pesos moleculares
experimentales de CO2
Método de
determinación
|
Densidad (g/cm3)
|
Porcentaje de error
%
|
Peso Molecular (g/mol)
|
Porcentaje de error
%
|
|
Diferencia de masas
|
2.78x10-3
|
40.4
|
68.8377
|
72.05
|
|
Diferencia de masas
corregida
|
1.73 x10-3
|
12.6
|
42.849
|
7.09
|
|
Ecuación de los gases ideales.
|
1.78 x10-3
|
10.1
|
-
|
-
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
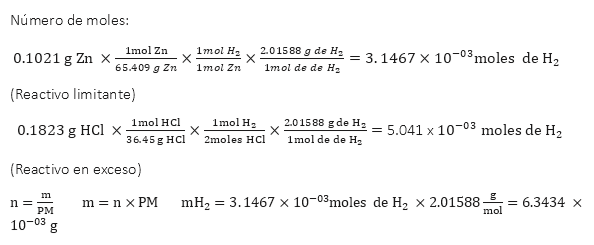
Experimento 2.
La reacción que se originó en el
experimento tuvo variaciones con respecto a la producción de H2,
mediante los siguientes cálculos se mostrara que el rendimiento que se obtuvo
fue distinto al que en teoría debió obtenerse.
Zn + 2HCl à ZnCl2 + H2
Datos a tomar en cuenta para realizar los
cálculos del volumen
T=298.15
1atm=760 mmHg
R=0.0821 L atm/K mol
Rendimiento
real=63ml
Formula de gases ideales. Se tomó
en cuenta que el H2 se comporta como un gas ideal en condiciones
normales de presión y temperatura.
Tabla 5.
Volumen
del gas:
|
V=63 ml
|
Gas producido:
|
H2
|
Ecuación
química
|
Zn + 2HCl à ZnCl2 + H2
|
||
Reactivo
limitante:
|
Zn
|
Reactivo en exceso:
|
HCl
|
Masa
teórica de H2
|
6.3434 x10-3
|
Masa real
H2
|
5.1883x10-3
|
Rendimiento
%
|
81.8%
|
Porcentaje de error:
|
18.2%
|
Figura 17. Volumen de gas H2 obtenido a partir de la
reacción.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Experimento 3. Cobre
Tabla 6.
|
Reactivos
|
Productos
|
Tipos de reacción
|
|
Cu + 4HNO3
|
Cu(NO3)2
+ 2NO2 + 2H2O
|
Sustitución
simple
Exotérmica
|
|
Cu(NO3)2 + 2NaOH
|
2Na(NO3)
+ Cu(OH)2
|
Sustitución
doble
Exotérmica
|
|
Cu(OH)2 + Calor (O2)
|
CuO
+ H2O
|
Descomposición
Endotérmica
|
|
CuO + H2SO4
|
CuSO4
+H2O
|
Sustitución
simple
|
|
CuSO4 + Al
|
AlSO4
+ Cu
|
Sustitución
simple
Exotérmica
|
Tabla 7.
|
Reacción Redox
|
Nombre del
compuesto
|
|
2H+(NO3)--+ Cu2+
à Cu2+(NO3)-2
+ H+2
|
Nitrato
cúprico
|
|
2Na+(OH)- + Cu2+(NO3)-2
à Cu2+(OH)-2 +
2Na+(NO3)-
|
Hidróxido
Cúprico
|
|
Cu2+(OH)-2 + 2Na+(NO3)-
à Cu2+O2- + H+2O2-
+ 2Na+(NO3)-
|
Oxido
cúprico
|
|
Cu2+O2- + H+2(SO4)2-à Cu2+(SO4)2-
+ H+2O2-
|
Sulfato
cúprico
|
|
Cu2+(SO4)2- +
Al2+ à Al2+(SO4)2-
+ Cu2+
|
Cobre
metálico
|
Porcentaje
de recuperación de Cobre:
%Recuperación =
La recuperación del cobre
fue de 15.236%
Porcentaje
de error:
Características
|
Reacción
|
Características
|
|
2HNO3 + Cu à Cu(NO3)2
+ H2
|
Líquido, Color verde/azul, Se desprendió un gas café
|
|
2NaOH + Cu(NO3)2 à Cu(OH)2 + 2Na(NO3)
|
Líquido, Azul turquesa
|
|
Cu(OH)2 + 2Na(NO3)à CuO + H2O + 2Na(NO3)
|
Sólido, Grumos negros.
|
|
CuO + H2SO4 à CuSO4
+ H2O
|
Líquido Azul claro, se desprendió calor
|
|
CuSO4 + Al à AlSO4 +
Cu
|
Sólido, Masa café, desprendimiento de gas, desprendimiento
de gas (Hidrogeno)
|
El porcentaje de recuperación fue de 15228% del cobre, es
imposible recuperar ésta cantidad de cobre debido a que en un inicio solo se
contó con 0.25g de Cu. La razón por la que sucedió esto fue debido a la
presencia de impurezas de CuSO4
y la presencia de moléculas de
agua, lo que hizo que obtuviéramos dicha recuperación.
Las fuentes de error por las que salió
muy alto el error fueron debido a la presencia de impurezas, además de cálculos erróneos al pesar. Es
importante señalar que el cálculo teórico de recuperación del cobre es de 0.23g
cuando debería ser de 0.25g mismo con el
que se inició la reacción, esto sucedió porque al realizar los cálculos solo se
tomaron en cuenta 2 decimales y al realizar los cálculos totales hay un déficit
de -0.02g de cobre.
Figura 18. Cobre obtenido.
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Experimento 4. Hidróxido de cobre
Tabla .
Filtro A
|
Precipitado + filtro B
|
Precipitado obtenido B - A
|
|
Masa (gr)
|
1.0988 g
|
1.7648 g
|
0.666 g
|
Fuente.
Laboratorio de Química Experimental, ITESM, Campus Puebla.
La
reacción química observada fue una reacción de doble sustitución representada
mediante la siguiente ecuación:
CuSO4
+ 2NaOHà Cu(OH)2+Na2SO4
A
partir de la ecuación anterior, se produce una masa teórica de 0.79545g de
hidróxido de cobre, tomando en cuenta un rendimiento del 100%.
20mlCuSO4
x 0.5 mol/1000ml x 1 molCu(OH)2/1molCuSO4 x 79,545g/1 molCu(OH)2
=0.79545g
La
masa de hidróxido de cobre obtenida experimentalmente fue de 0.666g, dando como
resultado un rendimiento del 83.73%. Finalmente se observó un precipitado azul
claro el cual disminuyó su volumen al secarse.
Figura 19. (De
arriba a abajo) Hidróxido de cobre filtrado. Hidróxido de cobre secado
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Discusión
Experimento 1.
Al pesar un objeto
que desplaza un volumen determinado de aire, la masa aparente del objeto es
menor que la masa real en una cantidad que es igual a la masa del aire
desplazado. La fuerza aparente que disminuye la masa medida es conocida como
error por flotación o efecto boya. Una vez la reacción química finalizó y se
produjo dióxido de carbono gaseoso como producto de la reacción. El error es
exponencialmente decreciente a medida incrementa la densidad, y presenta
valores elevados para sustancias menores a 1 g/cm3; por lo que se atribuyó este
error a la disminución en la masa del sistema por la formación de CO2.
(Harris, 2007)
La corrección
realizada a la masa experimental de CO2 producido disminuyo el
porcentaje de error de 0.27% a 0.07% con respecto al valor inicial, lo que demostró una aproximación más cercana
a la conservación de la masa considerando un al sistema un sistema cerrado.
Sin embargo, una vez
liberado el CO2 del sistema, el valor de masa corregido mostró el
mayor porcentaje de error (40.7%) con respecto al valor teórico, mientras que
el valor de masa medido por diferencia fue más exacto, con un porcentaje de
error de 12.38%. El valor de masa con menor porcentaje de error (9.95%)
corresponde al calculado a partir del volumen final en el globo.
El globo está
constituido por un material elástico, cuya tensión superficial debe ser
superada por la presión interna del mismo para causar una deformación. Una vez
superada la tensión, el volumen del globo aumenta y su presión interna disminuye
hasta un equilibro con la presión externa. Aproximando las condiciones del
laboratorio a condiciones normales (1 atm, 25ºC) se calculo un valor de masa
con un porcentaje de error de 9.95%, similar a la masa calculada sin corrección
por flotación. (Soler, s.f.)
Podemos afirmar, que
esta medición no es completamente exacta, debido a que el cálculo de volumen se
realizó en un ambiente de presión variable. Además, no se tomo en cuenta la
presión parcial ejercida por el aire dentro del sistema, ni el volumen al interior
del matraz, que no formaba parte del globo. Este aumento en el volumen, podría
resultar en un valor de masa más cercano al valor corregido. Finalmente,
tomando en cuenta los valores de masa finales,
el volumen del globo, y la similitud entre densidades de aire y CO2 podemos afirmar de forma tentativa, que
únicamente escapo del sistema una masa de gas equivalente a la masa contenida
únicamente dentro del volumen definido por el globo.
Experimento 2.
La producción de H2 a
partir de la reacción de Zn + HCl, presentó una variación con respecto al valor
teórico. El volumen real que obtuvimos fue de 63 ml, sin embargo, puede que
este volumen obtenido no se aproximó al valor teórico a causa de factores como
la temperatura, presión, velocidad de reacción, exactitud en la medición de
reactivos, entre otros. (Chang, 2010).
Por otra parte, el valor teórico
calculado no es un valor tan exacto puesto que para realizar los cálculos del
volumen en papel se toma en cuenta que el Hidrogeno se comporta como un gas
ideal, es decir, las partículas tienen un comportamiento constante y no
interactúan entre sí en condiciones de temperatura y presión normales. La
ecuación para gases ideales puede tener deficiencias si hay cambio de
temperatura o presión. (Chang, 2010).
Experimento 3.
Al realizar paso por paso el experimento se presentó el detalle de
no observar bien lo que sucedía durante cada reacción. Además a falta de tiempo
no se terminó todo el procedimiento del experimento por lo que se suspendió y
en la siguiente sesión se finalizó el experimento al pesar el Cobre que se
obtuvo.
Las razones por las que existe de exceso de Cobre recuperado es
por:
• Presencia de
impurezas.
• El cobre no dejó
secarse por completo.
Experimento 4.
La masa de hidróxido
de cobre obtenida experimentalmente fue de 0.666g, dando como resultado un
rendimiento del 83.73%. Este valor se debe a perdidas mecánicas del analito, al
momento de pesar el reactivo para soluciones, en los trasvases cuantitativos y
finalmente en la filtración. Para
disminuir la pérdida de partículas es necesario un papel filtro cuantitativo,
con poros de menor diámetro, y sistemas más eficientes, como filtración con
embudo de Buchner. (Harris, 2007)
Se observó disminución en el volumen del precipitado
debido a la que el hidróxido de cobre es un reactivo altamente higroscópico, y
al secarse, su volumen disminuyo de forma considerable.
Cuestionario
1. El sulfato
de cobre (II) penta-hidratado pierde el agua de hidratación al calentarse por
encima de 100ºC. ¿Cuántos gramos de sulfato de cobre (II) se obtienen al
calentar 10.5 g de la sal hidratada?
10.5g de CuSO4* 5H2O x
(159.62 g/mol de CuSO4 / 249.54 g/mol CuSO4* 5H2O)
=
6.716
g de CuSO4
2. Escriba y
balancee cada ecuación; indique el estado de oxidación de cada elemento; diga a
qué clase de reacción química pertenece:
Reactivos
|
Productos
|
Tipo de reacción
|
hidróxido
ferroso + peróxido de hidrógeno
|
Hidróxido de hierro (III)
|
Síntesis
|
plomo
+ ácido sulfúrico
|
Sulfuro de plomo + hidrógeno
|
Sustitución
|
amoníaco
+ óxido cuproso
|
Cobre + nitrógeno + agua
|
Descomposición
|
óxido
de nitrógeno (V)
|
Oxígeno + nitrógeno
|
Descomposición
|
hidróxido
de magnesio + cloruro de amonio
|
Amoniaco + cloruro de
magnesio + agua
|
Descomposición
|
a) 2Fe(OH)2
+ H2O2 à 2Fe(OH)3 Fe2+,
O2-, H1+ à Fe3+
b) Pb + H2SO4
à PbSO4 + H2 Pb0, S6+, H1+,
O2- à Pb2+, H0
c) 2NH3
+ 3Cu2O à 6Cu + 3N2 + H2O N3-, H1+, Cu1+,
O2- à Cu0, N0
d) 2N2O5
à 5O2 + 2N2 N5+,
O2- à O0, N0
e) Mg(OH)2
+ 2NH4Cl
à 2NH3 + MgCl2 +
2H2O Mg2+,
O2-, H1+, à N3-,
Cl1-
3. Para
preparar fosfato de bario, se combinan 3.50 g fosfato de sodio con 6.40g de
nitrato de bario.
a) Calcule la cantidad de fosfato de bario que
se puede obtener.
2Na3PO4
+ 3Ba(NO3)2 à Ba3(PO4)2
+ 6NaNO3
Na3PO4
= 163.9404 g/mol 0.02135mol
Ba(NO3)2
= 261.3368 g/mol 0.02449mol
3Ba(NO3)2
/ 2Na3PO4 = 1.5 0.02449
Ba(NO3)2 / 0.02449 Na3PO4 = 1.114
1.5 >
1.114 à R.L. es el Ba(NO3)2
6.4g Ba(NO3)2
x (1mol / 261.3368g Ba(NO3)2) x (1mol Ba3(PO4)2
/ 3mol Ba(NO3)2) x (601.9236g / 1mol Ba3(PO4)2)
= 4.9136g Ba3(PO4)2
b) Calcule el porcentaje de rendimiento si se
obtuvieron 4.70 g del producto.
%
rendimiento = (4.7g / 4.9136g) * 100 = 95.65%
4. Una muestra
de 12.6 g de cobre al 95% se hace reaccionar con exceso de ácido nítrico.
¿Cuántos gramos de nitrato de cobre (II) se pueden obtener si la eficiencia del
procedimiento es de 98%?
3Cu + 8HNO3 à 3Cu(NO3)2
+ 4H2O + 2NO
Cu = 63.546 g/mol
Cu(NO3)2 = 187.5558
g/mol
12.6 g Cuimpuro x (95 / 100) =
11.97g Cupuro
11.97g Cupuro x (1mol Cu / 63.546
g) x (3mol Cu(NO3)2 / 3mol Cu) x (187.5558g / 1mol Cu(NO3)2)
= 35.3294 g Cu(NO3)2
98 = (x / 35.32941) *100
x= 34.6228g Cu(NO3)2
5. Se trataron 7.00 g de una muestra X para analizar su contenido de cobre; con ese procedimiento, la obtención de cobre tiene un rendimiento del 98.5 %. La masa del producto obtenido fue de 6.35 g, pero se demostró que tenía 1.00%de impurezas. ¿Cuál es el porcentaje de cobre de la muestra X?
Hace falta indicar el procedimiento a seguir
y la reacción.
Conclusión
La materia se conserva en una
reacción química aunque los productos sean distintos a los reactivos, esto fue
comprobado cuando el Alka-Seltzer (bicarbonato de sodio) en reacción con el
ácido clorhídrico pasó de estado sólido a gas (dióxido de carbono) más cloruro
de sodio y agua.
En una reacción siempre hay un
reactivo que se termina primero, se le llama reactivo limitante y es el que
define la cantidad de producto que se formará. En el experimento dos se pudo
observar este fenómeno. Las reacciones no presentan un rendimiento del 100%
debido a errores e impurezas que se pueden presentar, por lo que es importante
calcular el porcentaje de rendimiento que se obtiene para saber que tan bien se
está trabajando y buscar los aspectos para mejorar.
Bibliografía
Chang,
R. (2010) Química, 10ª edición, Mc Graw Hill, China.
Harris, D.
(2007) Análisis químico cuantitativo. Editorial Reverte. Barcelona, España.
Otamendi,
S. (2001) Química 1. Editorial
Progreso. México, DF
Soler, V.
(s.f) Presión interior y presión exterior de un globo: tensión superficial.
Recuperado el 20 de febrero de 2013 de http://intercentres.edu.gva.es/iesleonardodavinci/Fisica/Cinetico-corpuscular/Globos/Globos.htm
Whitten,
K, et al. (2008) Química. Octava
edición. CEGANGE Learning. Traducido. México DF
Wilches,
M. (2007) Bioingeniería VI, Fundamentos
de Instrumentación para la Química
Clínica y las radiaciones ionizantes. Editorial Universidad de
Antioquia. Colombia.






















.JPG)


Zn(s) + CuSO4(ac) --> ZnSO4 + Cu (s)
ResponderEliminarSulfato de Zinc, no sulfito D:
Creo que tuviste un pequeño error de dedo tal vez.
Saludos.
Muy útil el post.
Gracias :D