Instituto
Tecnológico de Estudios Superiores de Monterrey
Campus
Puebla
Escuela
de Ingeniería y Ciencias Aplicadas
Departamento
de Biotecnología
Laboratorio de
Química Experimental-Q.1014.01
Dr. Isaac Monroy
Mtro. Víctor H. Blanco
Práctica 4: Técnicas experimentales básicas en el
laboratorio de química: extracción, sublimación y cristalización.
Equipo 7:
Laura Barba Castillo A01322562
Alejandro
Larios Campos A00399515
Rodrigo E. Hernández Jiménez A01324406
Brenda Berenice Jerónimo Atanacio A01324138
Fecha
de entrega: jueves 31 de enero de 2013
Objetivos
·
Desarrollar las habilidades motrices necesarias
para manejar adecuadamente las sustancias, el equipo y el material de
laboratorio.
· Conocer las técnicas básicas de separación de
mezclas: extracción, sublimación y cristalización.
· Identificar los métodos para separar los
componentes de una mezcla y adquirir habilidad en la aplicación de diferentes
métodos a través de la experiencia en el laboratorio.
·
Determinar constantes físicas como puntos de
fusión en sustancias puras y mezclas.
Introducción
A pesar de que existen sustancias
puras, en la naturaleza cualquier sustancia se encuentra mezclada o combinada
con alguna otra, es por ello la importancia del uso de los métodos de
separación de mezclas. En las mezclas, los componentes conservan sus propiedades
físicas y químicas y es mediante el uso
de separaciones como las sustancias pueden ser aisladas. Es importante conocer
y familiarizarse con las propiedades de los compuestos individuales de la
mezcla antes de elegir un método apropiado.
Los métodos de separación buscan
aislar alguna sustancia relevante para quien la extrae, pero cada método está
diseñado para usarse con determinadas sustancias que cumplen con las
propiedades indicadas para ser separado por dicho método.
El punto se fusión es importante
para determinar a través de tablas algún compuesto o sustancia desconocida,
Para reportar el punto de fusión se debe registrar la temperatura a la que la
sustancia comienza a fundirse y la temperatura a la que la sustancia está
totalmente líquida, esto se debe a la presencia de impurezas que impiden la
homogeneidad de la absorción de calor.
Los carotenoides son pigmentos
vegetales que se dividen en carotenos (que contienen oxigeno) y xantofilas (que
son puramente hidrocarburos y no contienen oxigeno). Los carotenoides absorben
la luz azul y son pieza clave en plantas y algas ya que pueden usarla en la
fotosíntesis y protegen a la clorofila
del fotodaño. En los humanos los carotenos tienen actividad de vitamina “A” y
pueden actuar como antioxidantes.
Desarrollo
Actividad 1. Para la separación
de beta carotenos y xantofilas se realizó el siguiente procedimiento.
1. Se cortó una zanahoria en pequeños trozos y se
trituró en un mortero hasta formar un puré, de igual forma se molieron dos
hojas de espinaca.
2. Posteriormente se colocó el puré, por separado,
en un vaso de precipitado de 400ml al que se le agregó agua y se dejó hervir
por 15 minutos.
3. Se coló el puré usando un papel filtro y un
embudo para quitar el exceso de agua.
4. Se colocó el puré en un matraz de Erlenmeyer de
250ml y se agregó 30ml de hexano previamente medidos en la probeta. Dejándolo
reposar por 10 minutos y agitando ocasionalmente.
5. Se prosiguió a decantar el hexano en un vaso de
precipitado de 250ml para quitar la pulpa.
6. El líquido decantado se vació en un embudo de
separación.
Figura 1. Colación
del puré de zanahoria por medio de papel filtro.
Fuente. Laboratorio
de Química Experimental, ITESM, Campus Puebla
Actividad 2. Extracción
1. El embudo se colocó en un soporte universal por
medio de unas pinzas de nuez.
2. El líquido decantado se vació en el embudo y se
agregaron 50ml de metanol. Se agitó y se dejó reposar para que se lograra una
separación de las dos fases.
3. Se recolectaron las dos fases por separado en
vasos de precipitado de 250ml.
4. De la capa metanólica se tomaron 2ml y se
colocaron en un tubo de ensayo para que se realizara la prueba de xantofilas.
5. Después de agregaron 2ml de HCl concentrado.
6. Para la capa hexanoica también se tomaron 2ml de
solución que se colocaron en un tubo de ensayo. Posteriormente se pesó 0.1g de
nitrito de sodio que se agregó al tubo de ensayo. Se adicionó 2.25ml de agua
destilada y 0.75ml de ácido sulfúrico al tubo. Esta es la prueba para beta
carotenos.
Figura 2. Equipo
para la separación de la parte metanoica y hexanoica.
Fuente. Laboratorio
de Química Experimental, ITESM, Campus Puebla
Actividad 3. Punto de fusión
de un sólido
1. Se tomó un tubo capilar, el cual fue sellado de
un lado usando el mechero y haciendo contacto con la uña para cerrarlo.
2. De un vidrio de reloj se tomó aproximadamente
1mm de la sustancia sólida y se hizo bajar suavemente.
3. Se sujetó el capilar a la parte inferior del
termómetro por medio de una liga y se introdujeron en el tubo Thiele,
previamente llenado con vaselina líquida, siendo sujetados por un tapón
colocado el en termómetro.
4. Se calentó el tubo Thiele por el extremo hasta que
se observó la fusión del sólido. Cuando esto ocurre, el sólido se hace
transparente.
5. Se registraron dos medidas de temperatura, la
primera cuando el sólido comienza a fundirse y la segunda cuando toda la
muestra es líquida. Se suspendió el calentamiento.
Figura 3. Recolección
de la sustancia en el tubo capilar
Fuente. Laboratorio
de Química Experimental, ITESM, Campus Puebla
Figura 4. Representación
del montaje del tubo Thiele para la determinación de punto de fusión.
Fuente. Cervantes
B. 2009
Actividad 4. Purificación de cafeína por sublimación
1. Se
colocó un poco de cafeína impura en un matraz Erlenmeyer.
2. Se
introdujo un tubo de ensayo al matraz, el cual se selló con algodón.
3. Se
colocaron hielos dentro del tubo de ensayo para acelerar la formación de los
cristales.
4. Se
calentó en un mechero el matraz con el tubo hasta que se observó la formación
de cristales.
5. Se
detuvo el calentamiento y se observaron los cristales.
6. Se
lavó el material.
Figura 5. Equipo para la sublimación de
la cafeína (matraz con café y tubo de ensayo con hielo)
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla
Resultados
a) Determinación de punto de fusión
Se reportó un rango de fusión
observado entre 124 y 134°C.
b) Separación y Extracción de Carotenos y Xantofilas
Los resultados de las pruebas
para detección de Xantofilas y Beta-Caroteno se presentan en la siguiente
tabla.
Tabla. Resultado de las pruebas de Xantofilas y Beta-Caroteno de Espinaca
y Zanahoria.
Prueba
|
Observaciones de cambio de color
|
Resultado de la prueba
|
Xantofilas
|
No se observó
|
Negativo
|
Beta-caroteno
|
Prueba fallida
|
No aplica
|
Fuente. Laboratorio de
Química Experimental, ITESM, Campus Puebla.
c) Purificación de Cafeína Impura usando la Técnica de Sublimación
Se observaron cristales adheridos
a la superficie del tubo de ensayo cuyas
propiedades físicas se presentan
a continuación.
Tabla. Propiedades físicas de la cafeína durante el proceso de
purificación por sublimación.
Propiedades
|
Cafeína Impura
|
Cafeína Pura
|
Color
|
Café oscuro
|
Blanco-amarillo
|
Olor
|
Amargo
|
-
|
Aspecto
|
Polvo
|
Cristales
|
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Figura 6. Sublimación de la cafeína
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Figura 7. Tubo de ensayo con cristales
de cafeína
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Discusión
a) Determinación de punto de fusión
En base al intervalo de fusión
obtenido se puede realizar las siguientes afirmaciones. De acuerdo con la tabla
proporcionada en la práctica, el compuesto cuyo punto de fusión es más cercano
a rango reportado corresponde a la urea, cuyo punto de fusión es de 133°C. El
intervalo es de 10°C, lo que podría deberse a impurezas presentes en la
muestra, ya que las sustancias puras poseen intervalos pequeños (entre 0.5 y
2°C) sin embargo, esto implicaría una disminución en el punto de fusión
observado de la Urea, el cual es mayor. Otra razón podrá deberse a errores en
la lectura, relacionados con la velocidad de calentamiento; si la tasa de
calentamiento es superior a los 2°C por minuto, se dará lugar a una diferencia
entre el equilibrio térmico de la sustancia en el capilar y la vaselina en el
tubo de Thiele. Esta última está en contacto directo con el termómetro, lo que
genera errores en la lectura. (Lide, 2010; Lamarque et al, 2008; Cervantes, 2009)
Otra fuente de error sistemático
procede de la calibración del termómetro, el cual puede registrar temperaturas
por encima o debajo del valor reportado en la literatura. Esto se soluciona con
una gráfica de calibrado. Múltiples ensayos de esta sustancia deben ser
llevados a cabo para determinar con más precisión la razón de este intervalo.
(Dupont & Gokel, 1985)
b) Separación y Extracción de Carotenos y Xantofilas
La prueba de Beta-carotenos no se
realizó debido a que la adición rápida de ácido sulfúrico provoco una reacción
exotérmica explosiva con el agua. En cuanto a la prueba de xantofilas, el
resultado fue negativo, debido a que no se observó un cambio de color a azul. (Sulfuric Acid MSDS, 2005; American Water
Works Association, 2010)
A pesar que la solución con
hexano adquirió un aspecto coloreado naranja, este era muy tenue, contrario a
la muestra de zanahoria, la cual poseía un color intenso, por lo que el
rendimiento de extracción fue muy bajo (Figura). Este rendimiento podría aumentarse procesando más
la muestra de zanahorias en el mortero y
aumentando el volumen de hexano o utilizando solventes alternativos como
el etanol, en el cual los carotenoides también son solubles. (Lide, 2010)
Figura 8. Separación de pigmentos
carotenoides de zanahoria.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
A partir de la separación en
hexano, se esperó extraer xantofilas en la fase metanólica del embudo de
extracción, debido a que este compuesto es mas afín por la presencia de los grupos hidroxilos en
su estructura. (Figura) Sin embargo, no se observó su presencia en solución con
ácido clorhídrico, debido a que en zanahoria representan el el 10% de los
carotenoides (junto con el alfa-caroteno), y los rendimientos de extracción
mencionados anteriormente fueron muy bajos. (Baudi, 1993; Lide 2010)
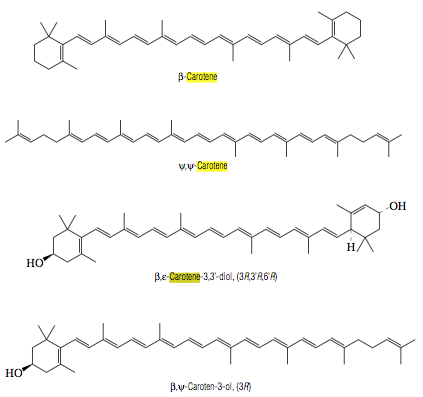
Figura 9. A) Estructura química del
Beta-Caroteno. C) Estructura química de las Xantofilas (β-ε-Carotene-3-3´-diol)
Fuente. (Lide, 2010)
c) Purificación de cafeína por sublimación
El café instantáneo debe su color
café obscuro a que está formado por una mezcla de diferentes compuestos, los
cuales son: Hidratos de carbono 41.10 g, agua 3.10 g, calcio 141.00 mg, hierro
4.40 mg, magnesio 327.00 mg, fósforo 303.00 mg, potasio 3,536.00 mg, sodio
37.00 mg, zinc 0.40 mg, cobre 0.10 mg, manganeso 1.70 mg, selenio 12.60 mcg,
proteína 12.20 g, grasas 0.50 g. (café en polvo, soluble Nescafé) En promedio
100gr de café instantáneo contienen 4g de cafeína.
Al calentar la muestra y llegar a
la temperatura de sublimación de la cafeína, la
cual es 90°C, lo que se legra es separar esta sustancia de los demás
componentes orgánicos del café. La cafeína se encuentra ahora en estado gaseoso
y al tocar el tubo con hielo que se encuentra alrededor de los 0°C la cafeína
se solidifica formando cristales blancos. (Lide, 2010)
Cuestionario
1. ¿Qué
son los carotenoides y en qué se clasifican?
Los carotenoides son una clase de
pigmentos naturales que son sintetizados por las plantas y son responsables de
los colores brillantes de varias frutas y verduras. Hay varias docenas de carotenoides
en los alimentos que comemos y la mayoría de estos carotenoides tienen
actividad antioxidante. Las mezclas de carotenoides o asociaciones con otros
antioxidantes pueden aumentar su actividad contra los radicales libres. Los
carotenoides pueden promover la salud cuando se toman en niveles dietéticos,
pero pueden tener efectos adversos cuando se toman en dosis altas.
Químicamente los carotenoides se
dividen en dos grupos: carotenoides hidrocarbonados, denominados carotenos, y
carotenoides oxigenados, denominados xantofilas. Estos 2 grupos pueden ser
estructuralmente subdivididos en 7 grupos:
• Hidrocarburos: Son carotenoides
que presentan en su estructura solamente átomos de carbono e hidrogeno. Este
grupo está representado por los carotenos (α, β, ᵞ)
• Alcoholes: Son carotenoides que
poseen un grupo hidroxilo (OH-). Las verduras tienen xantofilas como la
criptoxantina (3-hidroxi- β-caroteno) encontrada en frutas como el maíz
amarillo.
• Cetonas: Son carotenoides que
poseen grupos carbonilos, por ejemplo: la equinenona (4-ceto- β-caroteno)
encontrada en invertebrados marinos.
• Epóxidos: Son carotenoides que
presentan oxigeno entre carbonos formando ciclos, ejemplo: la flavoxantina
(5,6,5,6’-di-epoxi-zeaxantina)
• Éteres: Son carotenoides que presentan oxigeno entre carbonos como
la espiriloxantina (dimetoxil-licopeno)
• Ácidos: Son carotenoides que poseen un grupo carboxilo ligado a una
extremidad de la cadena carbónica pues poseen un anillo. El ejemplo principal
es la crocetina, pigmento del azafrán.
• Ésteres: Son carotenoides que tienen un grupo carboxilo entre
carbonos, engloban: a) ésteres de ácidos caroténicos como la bixina pigmento
del achiote rojo, b) ésteres de xantofilas como ácidos grasos comunes.
Fuente. (Moráis, 2006)
2. Menciona
3 mezclas que puedan separarse por filtración y 3 por sublimación.
·
Filtración:
i)
Fe2O3 + agua
ii) Al2O3
+ Solución acuosa
iii) Grafito +
Agua
·
Sublimación:
i)
CO2
ii) I
iii) Nafta de
alquitrán de hulla (p-diclorobenceno)
Fuente. (Seese, 1996)
3. ¿Cuántos tipos de extracción puede haber?
Menciona un ejemplo para cada uno de ellos.
·
Extracción
simple. Esta técnica consiste en realizar una equilibracion entre ambas
fases. Se utiliza cuando el valor de la
relación de distribución del componente a separar es elevado mientras que el de
los restantes es próximo a cero, de forma que el factor de separación tiene un
valor alto.
Ejemplo: H2O
+ CCl4
·
Extracción
por contracorriente. Es aquella en la que ambas fases se mueven en direcciones
opuestas y están en contacto continuo, tal como ocurren en la destilación
fraccionada. Se extrae la fase de contacto con porciones nuevas de los
disolventes. Ejemplo: Obtención de éter isopropílico para extraer
una solución acuosa de ácido acético.
·
Extracción por
circulación. En esta técnica se utiliza un flujo continuo de disolvente
orgánico a través de una disolución acuosa que contiene la mezcla a separar. Si
el disolvente es volátil puede ser reciclado mediante destilación y
condensación. Ejemplo: Utilización del extractor Soxhlet con un
disolvente orgánico a través de una solución acuosa.
·
Extracción
de pares iónicos. En este tipo de extracción el ion metálico forma, generalmente,
un compuesto cargado que puede ser un complejo, un quelato o un compuesto de tipo salino, y su carga se
neutraliza con una especie de carga opuesta que actúa como contra-ion. Puesto
que la mayoría de las especies inorgánicas son iónicas e insolubles en
disolventes inmiscibles con el agua, esta es una forma simple de transformarlas
en compuestos no cargados y extraíbles.
Ejemplo: Extracción
de Quelatos neutros.
·
Extracción
por solvatación. La extracción se
posibilita en este caso porque las moléculas
del disolvente se solvatan a los iones que forma el par. Se
utilizan disolventes oxigenados ya que
debido al carácter básico del oxígeno
éste puede interaccionar con el protón o con el ión metálico. Para este fin se
usan: éter etílico, cetonas y disolventes órgano-fosforados.
Ejemplo: Extracción
de Fe III en éter etílico por la formación
del complejo clorurado FeCl4-
·
Extracción
de aniones inorgánicos. El método implica la congelación y la
descongelación repetida de las muestras en lugar de la homogeneización o la
digestión de ceniza húmeda.
Ejemplo: Extracción
de iones inorgánicos, Ca, Mg, Mn, K, y P
y poliaminas celulares de pequeñas cantidades de madera y tejidos
vegetables.
·
Extracción
de ácidos y bases. Los ácidos y bases
orgánicos se pueden separar el uno del otro y de los compuestos neutros por
extracción usando soluciones acuosas de diferentes valores de pH. Los ácidos
carboxílicos más orgánicos son insolubles o ligeramente solubles en agua, pero
estos compuestos son altamente solubles en hidróxido de sodio acuoso diluido
porque el ácido se desprotona por la base
de la producción de la sal del carboxilato de sodio de esta manera puede
extraerse el ácido. Ejemplo: extracción de ácido benzoico a partir de
naftaleno.
·
Extracción
Sólido-Líquido. Es un método que permite componentes solubles para ser removido
de solidos utilizando un disolvente.
Ejemplo: extracción
de aceites a partir de semillas o de lixiviación de sales de metales a partir
de minerales.
Fuente. (Valcárcel, 1998); (Harris, 2007)
4. ¿Es qué
consiste la cristalización por evaporación?
Es una forma
sencilla de hacer cristales y que funciona mejor para compuestos que no son
sensibles a las condiciones ambientales en el laboratorio. Para realizarla se
siguen ciertos pasos:
1) Se debe preparar
una solución del compuesto en un disolvente adecuado, la cual debe ser saturada
o casi saturado.
2) Transferir
la solución a un plato de cristal limpio. La cubierta para el recipiente no
debe ser hermético al aire. Papel aluminio con algunos agujeros funciona bien,
o una pieza plana de vidrio como un portaobjetos de microscopio.
3) Colocar el
recipiente en un ambiente tranquilo y dejar que evapore. Este método funciona
mejor cuando existe material suficiente para saturar al menos unos pocos
mililitros de disolvente.
Fuente. (Holden, 1960)
5. ¿Por qué deben anotarse las
dos temperaturas (inicio y término) de un punto de fusión?
Es debido a la presencia de
impurezas en la muestra, esto hace que se funda en un intervalo de tiempo. Por
lo general el punto de fusión se reporta como un intervalo de fusión (las
temperaturas en las que la muestra se funde). (Department of Chemestry, 2004)
Conclusión
Se determinó un intervalo de
fusión de 124-134ºC para la muestra incógnita y se concluyó que corresponde a
Urea con alto grado de impureza. Esta medición fue afectada por múltiples
errores sistemáticos, como la falta de calibración del termómetro y un
calentamiento rápido.
La prueba de xantófilas fue
negativa para la extracción de carotenoides de zanahoria, por bajos
rendimientos en el procedimiento. En cuanto a la prueba de carotenos, esta
medición no se concluyó debido a errores sistemáticos en la mezcla de
reactivos, lo que generó una reacción explosiva entre el agua y el ácido
sulfúrico.
Finalmente, se obtuvo cafeína
purificada a partir de una muestra de café instantáneo por el método de
sublimación. Como residuos se generaron soluciones acuosas de ácidos sulfúrico
y clorhídrico, los cuales fueron desechados en el contenedor de ácidos
inorgánicos. También se generaron residuos orgánicos procedentes de la
extracción de Beta-Caroteno, Xantófilas de Zanahoria; y residuos de cafeína los cuales se
dispusieron en el contenedor de residuos orgánicos.
Bibliografía
American Water Works Association (2010) Algae: a
source to treatment. American Water Works Association. ISBN: 978-1-58321-787-0
Baudi, S (1993) Química de los Alimentos. Longman
de México Editores, S.A. de C.V. México. ISBN: 968-444-152-5
Cervantes, B. (2009) Manual pedagógico de prácticas
de química general en microescala. (3ra ed.) Universidad Iberoamericana A.C.
México D.F., México.
Department of Chemestry (2004) Melting Point
Determination.
Dupon, H. & Gokel, G. (1985) Química orgánica
experimental. Reverté S.A. Barcelona, España. ISBN: 978-84-291-7155-6.
Harris, D. (2007). Análisis Químico Cuantitativo.
Reverte. Barcelona, España.
Holden, A. (1960) Crystal Growing. Doubleday. New
York, U.S.A.
Lamarque, A. Zygadlo, J. Labuckas, D. López, L.
Torres, M. Maestri, D. (2008) Fundamentos teórico-prácticos de química
orgánica. (1º ed.) Editorial Encuentro. Argentina. ISBN: 978-987-1432-09-7.
Lide, R. (2010) CRC Handbook of Chemistry and
Physics. (90 ed.) CRC Press.
Moráis, F. (2006) Carotenoides: Características
Biológicas y Químicas. Brasilia. Recuperado 30 de enero de 2013 de:
http://bdm.bce.unb.br/bitstream/10483/546/1/2006_FlaviaLuisaMorais.pdf
Seese, W. (1996) Química. Pearson.
Sulphuric Acid MSDS. (2005) Sciencelab.com.
Recuperado el 29 de enero de 2013 de
http://www.sciencelab.com/msds.php?msdsId=9925146
Valcárcel, M. (1988) Técnicas Analíticas de
Separación. Reverte. España.









No hay comentarios:
Publicar un comentario