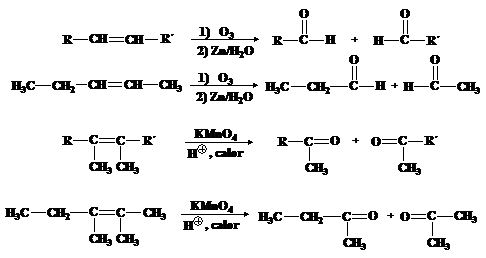Instituto Tecnológico de Estudios
Superiores de Monterrey
Campus Puebla
Escuela de Ingeniería y Ciencias
Aplicadas
Departamento de Biotecnología
Laboratorio de Química Experimental-Q.1014.01
Dr. Isaac Monroy
Mtro. Víctor H.
Blanco
Práctica 15: Propiedades de los alcoholes y síntesis
de aldehídos y cetonas
Equipo 7:
Laura Barba Castillo
A01322562
Alejandro Larios Campos A00399515
Rodrigo E. Hernández
Jiménez A01324406
Brenda Berenice
Jerónimo Atanacio A01324138
Fecha de entrega: jueves 21 de marzo de
2013
Objetivo:
Ø Comprobar
algunas de las propiedades de los alcoholes y sintetizar un aldehído y/o cetona
a partir de su oxidación.
Introducción
Los alcoholes reaccionan con
ácidos carboxílicos para dar ésteres, la reacción puede darse en un solo paso
si se utiliza como catalizador un ácido fuerte aunque con frecuencia se mejora
la reactividad del ácido carboxílico al convertirlo primero en un cloruro de
ácido carboxílico, el cual reacciona con el alcohol. (McMurry, 2008)
La conversión de alcoholes
primarios en aldehídos requiere un cuidadoso control de condiciones de
reacción, ya que el aldehído es mi susceptible a oxidarse. El procedimiento
consiste en añadir cantidades limitadas de oxidante y destilar el aldehído, por
su punto de ebullición más bajo que el alcohol. Los productos de oxidación de
los aldehídos son los ácidos carboxílicos. El permanganato de potasio, es un
buen oxidante de alcoholes primarios. La oxidación de alcoholes primarios con
permanganato da lugar al ácido correspondiente.
Para la oxidación de alcoholes
secundarios se una el ácido crómico y permanganato de potasio en medio básico.
El producto de oxidación es la cetona que en general son estables y no sufren
reacciones posteriores.
Los alcoholes terciarios son
resistentes a la oxidación, solo en condiciones muy ácidas, se deshidratan a
alquenos que por posteriores reacciones se fragmentan en moléculas más
pequeñas. (Santiago, 1995)
La esterificación de alcoholes
consiste en tratar al ácido con exceso de metanol y un catalizador (HCl, H2SO4). El mecanismo de esterificación de
alcoholes primarios y secundarios (SN2).
El ácido se combina con un protón, formando un ion oxonio, que reacciona con
R’OH generando agua. La acción catalítica del protón puede ser realizada
igualmente por otros receptores de electrones (ácidos de Lewis)
La esterificación de alcoholes
terciarios tiene lugar a través de la formación de un ion carbonio, R3C+, lo
que hace que el OH proceda del alcohol, no del ácido (Fieser, 1985)
Desarrollo
Experimento
1. Solubilidad
1.
Se
vació un mililitro de agua en cuatro tubos de ensayo y a otros cuatro tubos se
les agregó un mililitro de éter.
2.
Posteriormente
se agregaron 10 gotas de metanol a un tubo, isopropanol a otro, glicerina al
siguiente y etanol al último. Se repitió el procedimiento con los tubos que
contenían éter.
3.
Se
observó la solubilidad en cada tubo.
Figura 1.
Tubos de ensayo para observar la solubilidad.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Experimento
2. Esterificación
1. Se
rotularon 3 tubos de ensayo con: alcohol metílico, alcohol Isopropílico y
alcohol etílico respectivamente, se le
añadieron a cada tubo 1.5 ml de su respectivo alcohol y además 1.5ml de ácido
acético a cada uno.
2. Se
añadieron 8 gotas de ácido sulfúrico concentrado a cada tubo de ensayo.
3. Se
calentaron en baño María. Una vez que alcanzaron su punto de ebullición, se
dejaron por 3 minutos más.
Figura 2.
Soluciones calentándose hasta el punto de ebullición.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
4.
Una vez finalizados los 3 minutos, a
cada tubo se le agregaron 25 ml de agua helada. Se taparon y mezclaron.
Figura 3.
Soluciones con el alcohol correspondiente, ácido acético, H2SO4
y agua fría.
Fuente. Laboratorio de Química Experimental, ITESM,
Campus Puebla.
5.
Finalmente se trató de identificar el
aroma de cada solución como agradable o desagradable.
Experimento
3. Oxidación de los alcoholes
1. Se
rotularon tres tubos para cada alcohol con el nombre referido: etílico,
metílico e isopropílico y se agregó 1ml de este respectivamente.
2. Se
agregaron 20 gotas de H2SO4 diluido.
3. Para
cada muestra de un alcohol se agregaron 5 gotas de solución de KMnO4
al 5%, cromato de potasio o dicromato de potasio.
Figura 4.
Indicadores de potasio.
Fuente. Laboratorio de Química Experimental, ITESM,
Campus Puebla.
4.
Se calentó y se registró el olor.
Experimento
4. Identificación de aldehídos
1. Se
agregaron x gotas del reactivo de Tollens a 5 tubos de ensayo.
2. Para
cada tubo se agregaron 2 gotas de una muestra diferente, las cuales eran:
sacarosa, glucosa, fructosa, lactosa y maltosa.
3. Se
calentó.
4. Se
observó si ocurría la formación de un espejo de plata.
Figura 5. Ejemplo: formación del espejo de plata.
Fuente.
Laboratorio de Química Experimental, ITESM, Campus Puebla.
Resultados
Experimento
1. Solubilidad
Tabla.
Solubilidad de algunos alcoholes dentro de agua y dentro de éter.
Alcohol
|
Solubilidad en agua
|
Solubilidad en éter
|
Metanol
|
Soluble
|
Poco soluble
|
Etanol
|
Soluble
|
Poco soluble
|
Isopropanol
|
Soluble
|
Poco soluble
|
Glicerol
|
Insoluble
|
Insoluble
|
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Experimento
2. Esterificación
Esterificación
|
Muestra de
Alcohol
|
Tipo de
Ácido
|
Catalizador
|
Olor
|
1ra
|
Alcohol etílico
|
Acético
|
Ácido sulfúrico
|
-Desagradable
-Olor concentrado de ácido acético
|
1ra
|
Alcohol isopropílico
|
Acético
|
Ácido sulfúrico
|
-Agradable
-Olor similar a menta
|
1ra
|
Alcohol metílico
|
Acético
|
Ácido sulfúrico
|
-Desagradable
-El aroma es poco perceptible
|
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Esterificación
|
Reacciones
|
1ra
|
C2H4O2
+ C2H6O à C4H8O2 + H2O
|
1ra
|
C2H4O2 + C3H8O à C5H10O2 + H2O
|
1ra
|
C2H4O2
+ CH4O à C3H6O2 + H2O
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Experimento
3. Oxidación de los alcoholes
Los alcoholes se oxidan para formar cetonas, aldehídos o
ácidos carboxílicos.
Tablas.
Oxidación
de alcoholes con diferentes sustancias.
Ø Permanganato
de potasio
Muestra de alcohol
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Precipitado café
|
Dulce
|
Morado à café
|
Metílico
|
Precipitado café
|
---
|
Morado à café
|
Isopropílico
|
Precipitado café
|
---
|
Morado à café
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Ø Cromato
de potasio
Muestra de alcohol
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Precipitado café
|
Frutal
|
Arriba: verde à azul
Abajo: naranja
|
Metílico
|
Precipitado café
|
---
|
Amarillo à naranja
|
Isopropílico
|
Precipitado café
|
---
|
Arriba: verde musgo
Abajo: naranja
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Ø Discromato
de potasio
Muestra de alcohol
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Ningún precipitado
|
Jugo de manzana
|
Verde agua à azul
|
Metílico
|
Ningún precipitado
|
---
|
Naranja
à amarillo
|
Isopropílico
|
Ningún precipitado
|
---
|
Arriba: verde agua à azul
Abajo: amarillo
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Figura 6. Respectivo alcohol con H2SO4 y su
oxidante, de izquierda a derecha en grupos de tres tubos: permanganato de potasio, cromato de potasio y dicromato de potasio
Fuente.
Laboratorio de Química Experimental, ITESM, Campus Puebla.
Experimento
4. Identificación de aldehídos
En la siguiente tabla se
muestran los resultados de la prueba realizada a diversos azúcares para
comprobar la presencia o no de aldehídos por medio del reactivo de Tollens.
Muestra
|
Reacción (+) o (-)
|
Sacarosa
|
-
|
Glucosa
|
+
|
Fructosa
|
+
|
Lactosa
|
-
|
Maltosa
|
-
|
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Fuente. Laboratorio de Química
Experimental, ITESM, Campus Puebla.
Discusión
Experimento
1 y 2. Solubilidad y Esterificación
El grupo –OH de los alcoholes forma puentes de hidrógeno con
el agua, sin embargo la cadena de carbono es la parte apolar de la molécula y
esto es lo que le da un cierto grado de insolubilidad en agua, es decir, entre
mas grande sea la cadena carbonada del alcohol, este sera menos soluble en
agua. En el caso de la glicerina, cuando el –OH funciona como radical este es
hidrofóbico por lo tanto no favorece la solubilidad en agua.
El éter es muy utilizado dentro del laboratorio como
disolvente orgánico por ser estables y no reactivos, pero algunos otros forman peróxidos con el oxigeno del aire. El grupo –OH de los alcoholes se une con el
R-O-R pero la parte apolar de las moléculas es la que hace que se presenten las
dos faces (McMurry 2008).
Los ácidos
junto a algún alcohol en presencia de un catalizador prótico dan como
resultado la formación de ésteres. Es una reacción reversible ya que los
ésteres en presencia de agua producen un alcohol más un ácido, es por ello que
debe utilizarse un catalizador. Analizando las reacciones, es probable que el
uso del agua provoca que no se pueda distinguir el aroma del éster ya que, el
agua rompe los enlaces –COO-.
Experimento
3. Oxidación de los alcoholes
En presencia de un agente
oxidante, los alcoholes primarios se oxidan a aldehído y posteriormente a ácido
carboxílico. Ejemplos de alcoholes primarios son el metanol, etanol y alcohol
isopropílico. (Yurkanis, 2008)
Oxidación del etanol:
CH3CH2OH
à CH3CHO à CH3COOH
El permanganato de potasio es
un oxidante fuerte de intenso color violeta. Como se observó en la práctica, en
presencia de alcoholes primarios, en medio neutro, este se reduce a oxido de
manganeso II, formándose un precipitado de color pardo. Esta reacción fue
espontanea, con un potencial estándar de reducción de 1.692V, de acuerdo con la siguiente ecuación:
MnO4-
+ 4H+ + 3e- ßà MnO2(s) + 2H2O
En disolución ácida, el ion
dicromato, de color naranja, es un oxidante fuerte que se reduce a ion crómico
de acuerdo con la siguiente ecuación:
Cr2O72-
+ 14H+ + 6e- ßà 2Cr3+ + 7H2O Eº = 1.36V
En presencia del ion dicromato,
tanto el metanol, etanol como el alcohol isopropílico se oxidaron. La presencia
de cromo3+ torno las soluciones verde - azuladas. (Harris, 2007)
El cromato de potasio, posee un
color inicial amarillo. En presencia del ion cromato, tanto los tres alcoholes
se oxidaron, dando como resultado soluciones café para el alcohol metílico e
isopropílico y naranja para el etanol. (Harris, 2007)
Experimento
4. Identificación de aldehídos
Los
aldehídos son sustancias de fórmula general RCHO. Los aldehídos y cetonas
contienen el grupo carbonilo, C=O, y a menudo se denominan colectivamente compuestos carbonílicos, que es que
determina en gran medida la química de estos compuestos. El grupo carbonilo de
los aldehídos contiene un hidrógeno, mientras que el de las cetonas tiene dos
grupos orgánicos, esto afecta de forma que los aldehídos se oxidan con
facilidad y suelen ser más reactivos que las cetonas en adiciones
nucleofílicas.
Aldehídos
y cetonas se caracterizan por la adición de reactivos nucleofílicos al grupo
carbonilo, en especial derivados del amoniaco.
Los
aldehídos se distinguen en particular de las cetonas por su facilidad de
oxidación: los aldehídos dan prueba de Tollens positiva, mientas que para las
cetonas es negativa.
(Thornton&
Neilson, 1998)
El
reactivo de Tollens es una solución de nitrato de plata en hidróxido de amonio.
Conforme el aldehído se oxida a la sal de un ácido carboxílico, el ion plata Ag+
se reduce a plata metálica. Si la
reacción se lleva a cabo en un tubo de ensayo la plata se deposita en las
paredes del vidrio y crea una superficie reflejante lisa, de ahí el nombre de
prueba de espejo de plata.
La
reacción que se lleva acabo es la
siguiente:

(Bailey
& Bailey, 1998)
Las
sustancias que dieron positivo a la prueba de Tollens fueron la glucosa y
fructosa. Como se puede ver en la imagen la glucosa presenta al grupo carbonilo
como aldehído, por lo que es positiva en la prueba de Tollens.
La
fructosa da prueba positiva de Tollens (azúcar reductor) debido al equilibrio
tautomérico ceto-enol catalizado por base, lo que da por resultado su
conversión en una aldohexosa como se muestra en la imagen:
(UNAM)
La sacarosa
es un disacárido formado por glucosa y fructosa, cuyo enlace implica al grupo aldehído
de la primera y al grupo cetona de la segunda, por lo que ninguno puede actuar
como reductor.
La lactosa
es un disacárido formado por galactosa y glucosa, donde la galactosa no tiene
efecto reductor, pero sí la glucosa, pues su grupo aldehído del C1 no está
implicado en el enlace. La maltosa se forma por dos moléculas de glucosa unidas
por enlace α(1,4) con un grupo aldehído libre, por lo que puede actuar como
reductor. Ambas presentaron un color negro en el tubo, pero no se llegó a
formar el espejo de plata.
Las estructuras
de estos disacáridos se presentan a continuación:
Cuestionario
1.
Explicar el mecanismo de solubilidad del
glicerol en éter.
La
glicerina es un buen soluto en agua y alcoholes de cadena pequeña. Sin embargo,
al agregar el éter como solvente, ésta se vuelve insoluble debido a que la
estructura del éter evita que se unan los grupos hidroxilos libres con la
glicerina, de igual forma no se pueden formar puentes de hidrógeno porque los
grupos –OH de la glicerina le dan una cierta polaridad a la molécula.
2. Escribir
la reacción química que se efectúa al reaccionar el etanol con sodio. ¿Qué gas
se desprende de esa reacción?
2C2H5OH
+ 2Na à 2C2H5Na + H2
El
gas que se desprende es Hidrogeno.
3.
Escribe
la estructura de los productos de oxidación esperados en la oxidación de los
alcoholes usados en tu experimento. Si no observaste reacción con ninguno de
los alcoholes explica por qué.
Etanol CH3CH2OH à CH3CHO
à CH3COOH
Metanol CH3OH
à CH3CHO à CH3COOH
Alcohol isopropílico CH3CH(OH)CH3 à CH3COCH3
à CH3COOCH3
4.
¿Cómo
identificó el grupo carbonilo en aldehídos y cetonas?
En
los aldehídos el grupo carbonilo se encuentra siempre al inicio de la cadena
puesto que solo se une con un hidrogeno y un -R, nunca dentro de la cadena. Por
otra parte el grupo carbonilo en cetonas se encuentra dentro de la cadena como:
R-CO-R. Ejemplo:
CH3CH2CH2CH2CHO CHCOCH3
Pentanal Propanona
(Macy 2005)
5. Escriba
la reacción que permitió dicha identificación.
6. ¿Cómo diferenció a un aldehído de una cetona?
El grupo carbonilo de los aldehídos contiene un hidrógeno,
mientras que el de las cetonas tiene dos grupos orgánicos, esto trae como
consecuencia que los aldehídos se presentan mayor facilidad de oxidación: los
aldehídos dan prueba de Tollens positiva, mientas que para las cetonas es
negativa.
(Thornton&
Neilson, 1998)
7. Escriba
la o las reacciones que le permitieron diferenciar uno de otro.
CH3HC=O + 2Ag(NH3)2OH
à CH3OHC=O
+ 4NH3 + H2O+ 2Ag
8. Complete
el siguiente cuadro indicando sus resultados:
|
Compuesto
|
Reacción con ácido crómico
|
Reacción de Tollens
|
|
Aldehído alifático
|
Precipitado
café
|
Espejo de
plata
|
|
Aldehído aromático
|
---
|
---
|
|
Cetona alifática
|
---
|
Espejo de
plata (fructosa)
|
|
Cetona aromática
|
---
|
---
|
Fuente. Laboratorio de Química Experimental, ITESM, Campus Puebla.
Conclusión
Los alcoholes como el metanol,
etanol e isopropanol son polares y solubles en compuestos polares como el agua y
poco solubles en compuestos no polares como el éter. El glicerol es insoluble
en ambos compuestos mencionados anteriormente. Los alcoholes mencionados
anteriormente se transforman en ésteres al reaccionar con ácido acético y en presencia
de ácido sulfúrico como catalizador.
El alcohol etílico presenta un
olor agradable al oxidarse en un éster. El permanganato, cromato y dicromato de
potasio son agentes oxidantes de alcoholes primarios.
La glucosa es un aldehído, ya
que presentó espejo de plata. La fructosa, cetona, se vuelve aldehído al llegar
al equilibrio ceto - enólico. Los azúcares como la sacarosa, lactosa y maltosa
son cetonas al no presentar espejo de plata.
Bibliografía
Bailey, P. & Bailey, C.
(1998) Química orgánica: conceptos y aplicaciones. Pearson Educación.
Facultad de química, UNAM.
Carbohidratos.
Fieser, L. (1985) Química
Orgánica Fundamental. Reverté. Barcelona, España.
Harris,
D. (2007) Análisis químico cuantitativo. Editorial Reverte. Barcelona, España.
Macy, R. (2005). Química
Orgánica simplificada. Reverte. España.
McMurry, J. (2008) Química
Orgánica. 7ª Edición. Cengage Learning. México.
Santiago, F. (1995) Cinética y
Mecanismo de la Reacción de Oxidación de 1-2 Etanodiol, 1-3 Propanodiol y 2-3
Butanodiol por Hexacianoferrato (III) Alcalino Catalizada por Tricloruro de
Rutenio. Universidad de Castilla – La mancha. Murcia, España.
Thornton,
R. & Neilson, R. (1998) Química orgánica, 5ED. Pearson Educación. Massachusetts,
E.U.A.
Yurkanis, P. (2008) Química
Orgánica. (5º ed.) Pearson Educación. México.